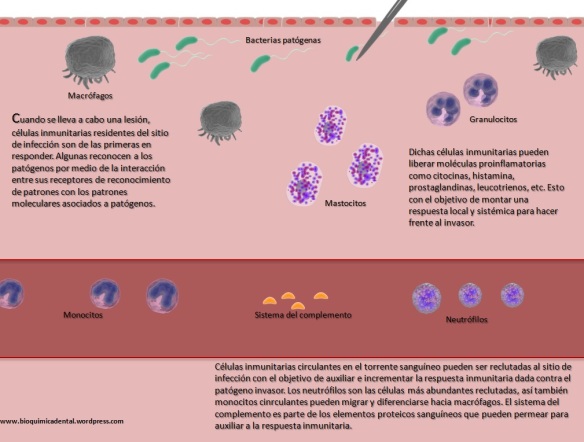
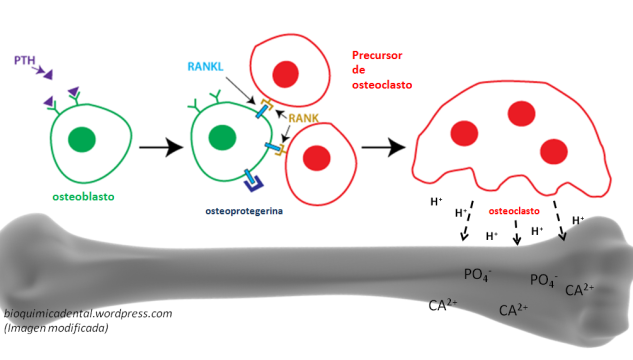
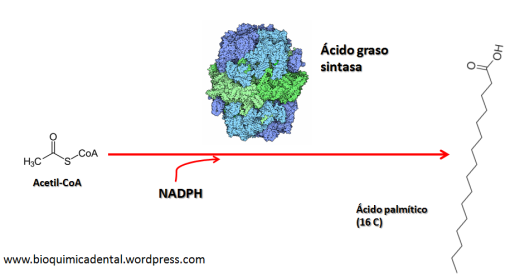
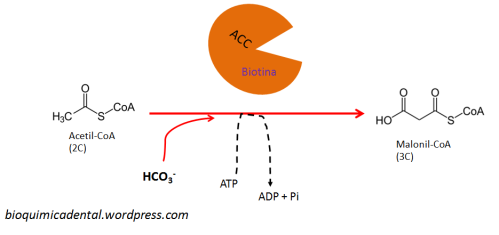
El sistema del complemento (SC) esta constituido por un grupo de más de 40 proteínas plasmáticas, que son sintetizadas en forma de precursores inactivo en el hígado y que participan en la inmunidad innata, además de promover la respuesta adaptativa mediante diferentes procesos. La activación de estas proteínas ocurren mediante 3 diferentes vías, que convergen en la escisión del componente 3 (C3) del complemento. Mediante el SC se puede combatir a los patógenos al recubrirlos y marcarlos (opsonización) para su fagocitosis; también sirve para la formación de poros en sus superficies que conduce a que se «hinchen» al llenarse fluido externo y finalmente exploten (complejo de ataque de membrana), además de que puede actuar como un sistema que a la par de estos procesos incremente la respuesta inflamatoria. El SC funciona de manera secuencial, lo que produce una serie de reacciones en cascada.
Las 3 vías por las cuales las proteínas del complemento son activadas son: la clásica, alternativa y la de las lectinas. Las 3 pueden conducir a la formación de complejos enzimáticos denominados C3 convertasas y C5 convertasas.
Vía clásica
En la vía clásica participan las proteínas C1q, C1r, C1s, C4, C2. Esta vía puede ser activada por la formación de un complejo antígeno-anticuerpo. Al darse este reconocimiento se dará una cascada de eventos que conducirán a la destrucción del agente patógeno.
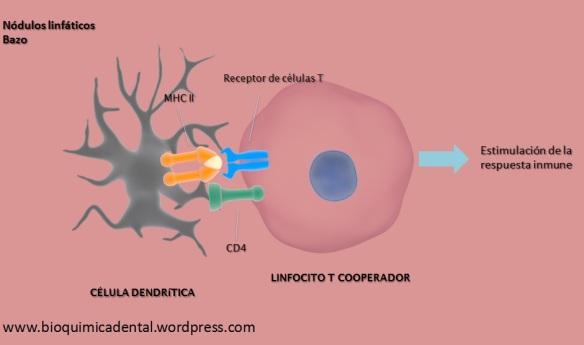
Cuando se da el reconocimiento del antígeno por medio de anticuerpos el complejo 1 (C1) puede a su vez unirse al anticuerpo.El C1 se compone de la unión de varias subunidades proteicas:
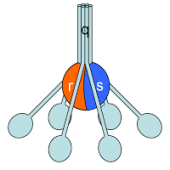
Estructura del C1. Se muestra este complejo ensamblado con sus subunidades correspondientes.
- 6 moléculas de C1q
- 2 moléculas de C1s
- 2 moléculas de C1r
La región constante de ciertos anticuerpos (Ig M o IgG) pueden unirse a la molécula C1q de complejo C1. Esto conducirá a la activación de C1s y C1r. C1s es una serin-proteasa que puede activar a las proteínas C2 y C4 del complemento. Cuando C2 y C4 son escindidos y, por lo tanto, convertidos a sus formas activas (C2a, C2b; C4a, C4b, respectivamente), C4b y C2a se asocian para formar un complejo enzimático. El complejo C4b.C2a también denominado C3 convertasa tendrá como actividad catalítica escindir para activar a la proteína C3 (Figura 2).
C3 es la proteína más abundante del sistema del complemento y cuando es escindida se forman sus productos activos. La C3 convertasa actúa como una serina proteasa que hidroliza C3 en dos subunidades: C3a y C3b, mismas que son funcionales y que pueden llevar a cabo los siguientes procesos mencionados.
C3a es una anafilotoxina que estimula a mastocitos y otras células para que liberen mediadores de la inflamación como histamina.
C3b puede unirse a la membrana celular de ciertos patógenos para funcionar como una opsonina. Mediante la unión covalente a glicoproteínas de membrana, C3b favorece el reclutamiento de células fagocíticas para la eliminación del patógeno.
La opsonización es un proceso por medio del cual las proteínas del complemento recubren la superficie externa de los patógenos lo que permite la fagocitosis de manera más fácil, pues algunas células fagociticas, como macrófagos y neutrófilos, contienen receptores especiales que reconocen a las opsoninas.
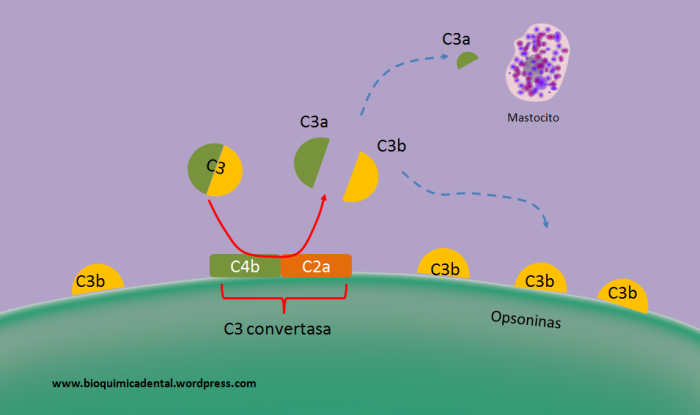
Figura 2. Función de la C3 convertasa. Dicha enzima (constituida por las subunidades C4b.C2a) puede escindir a la proteína C3 en sus formas activas, C3a, que tendrá una función estimulando a eosinófilos y mastocitos y C3b, que puede ser una opsonina para que se lleve a cabo el proceso de fagocitosis.
C3b puede dar lugar a la formación de la convertasa de C5.
Asimismo C3b puede tener otras funciones, como ser parte de la convertasa C3/C5. Al unirse como C4b y C2a (Figura 3), tiene a lugar a la formación de una convertasa que aparte de poder seguir convirtiendo a C3 en sus formas activas, también podrá escindir a C5 en sus formas activas, C5a y C5b, los cuales tendrán efectos sucesivos en la respuesta inmunitaria (ver más adelante).
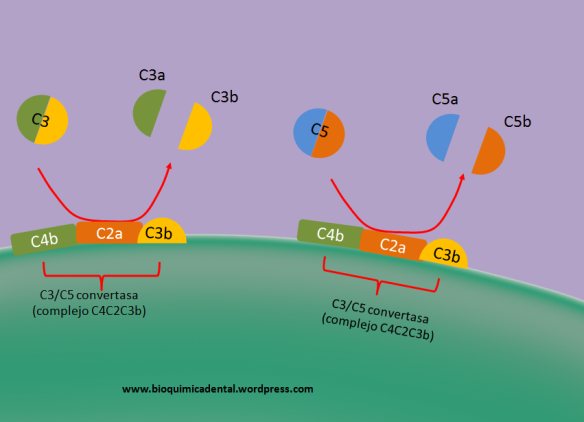
Figura 3. Formación de la C3/C5 convertasa.
Vía alternativa
La vía alternativa la constituyen y llevan a cabo principalmente el Factor D, Factor B, Properdina y C3b (Figura 4).
La vía alternativa inicia cuando C3b se asocia con el Factor B (Bb) y el Factor D para formar en complejo C3bBb que también se denominará C3 convertasa.
Sin embargo, la vía alternativa también puede formar otra convertasa, en este caso utilizando Properdina. Al asociarse C3b con el Factor B y Properdina forman otro tipo de C3 convertasa que también se denomina C3bBb.
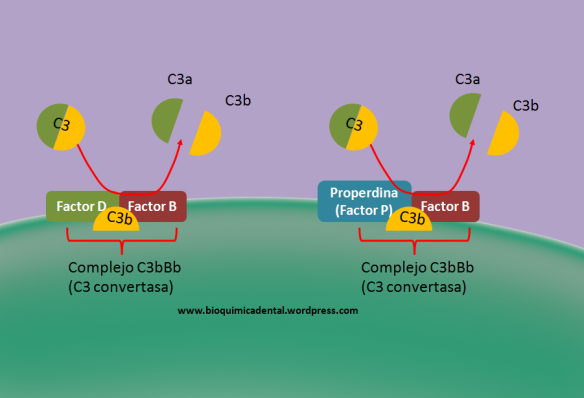
Figura 4. Vía alternativa del sistema de complemento. La asociación de C3b junto con el factor D y B puede dar al complejo C3bBb, así como también su asociación con el factor P y B. En ambos casos su función de dichos complejos es la formación de la C3 convertasa.
Esta vía es activada incluso en la ausencia del complejo antígeno-anticuerpo. De manera espontánea, la proteína C3 puede convertirse en C3a y C3b. Sin embargo, cuando se encuentra cerca de células sanas puede ser inactivada al unirse a su membrana plasmática.
El complejo C3bBb es una convertasa C3 y puede actuar en moléculas C3 para formar el complejo C3BbC3b que activa a C5, de tal manera que C5b puede formar el MAC. Asimismo este complejo puede actuar en C3b, lo que amplifica la respuesta.
Vía de las lectinas
En la vía de las lectinas participan proteínas como la lectina de unión a manosa (MBL), Ficolina, MASP-1, MASP-2 (Serin proteasa asociada a manosa 1 y 2), C4 y C2.
En esta vía, la Ficolina puede unirse a oligosacáridos con manosa presentes en la superficie de patógenos como bacterias, hongos, protozoarios y virus, asociándose con MASP-1 y MASP-2.
La MBL reconoce de manera específica residuos de manosa (carbohidrato), también de la superficie bacteriana y que al igual que la ficolina se puede asociar a MASP-1 y MASP-2.
Esencialmente, estos complejos formados catalizan la formación del complejo C3 convertasa (C4bC2a), por lo que tiene una función similar a la vía clásica, a pesar de tener procesos de formación diferentes.
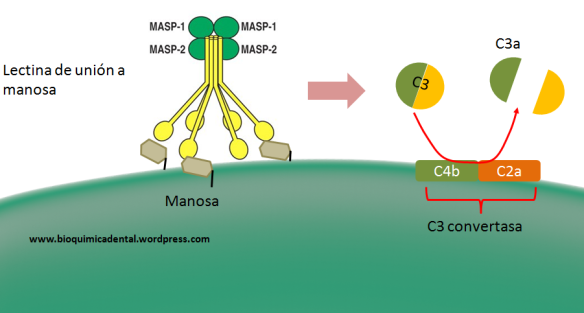
Figura 5. Vía de las lectinas de unión a manosa.
Función de C5a y C5b en la inmunidad innata
Mientras que C5a puede incrementar la inflamación y actuar como agente quimiotáctico (lo que significa que puede atraer células inmunitarias como neutrófilos), C5b sirve como la base para formar el MAC. Uniéndose a C6, C7 y C8 forman el complejo C5b.C6.C7.C8 el cual recluta a moléculas de C9 para que se unan a la membrana de la célula patogénica lo que forma un canal que lleva al llenado de la bacteria con fluido y eventualmente causa su lisis.
Regulación del sistema del complemento:
Varias proteínas son utilizadas para regular la cascada del complemento. El factor I inactiva a C3b, mientras que el factor H remueve la proteína Bb del complejo mencionado. El inhibidor de C1 se une al complejo C1 e inhibe la activación de C2 y C4.
Sistema del complemento y periodontitis
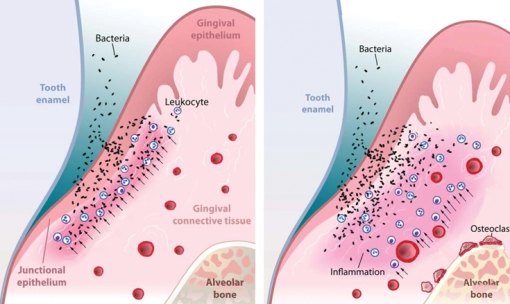
En personas sanas, se ha observado que existen bajos o ausentes niveles de componentes activados del complemento en el líquido crevicular gingival, pero en presencia de periodontitis (grupo de enfermedades inflamatorias que afecta los tejidos de soporte del diente) se han encontrado concentraciones altas de C1q, Factor B, Factor Bb, C3, C3a, C3b, C3c, C3d, C4, C5,C5a, C5b y C9 tanto en la superficie de bacterias subgingivales como libre en el mismo fluido. El incremento de esta activación local, tiene como consecuencia el incremento de la respuesta inflamatoria local que resulta en un incremento de la permeabilidad vascular, la vasodilatación y el reclutamiento de células inflamatorias (figura 6), lo que resulta en una liberación excesiva de especies reactivas del oxígeno, enzimas proteolíticas e interleucinas.
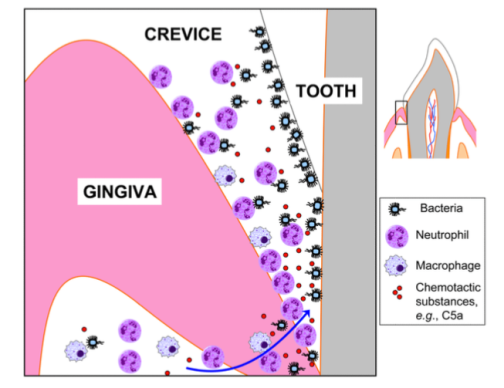
Figura 6. Células inflamatorias, como neutrófilos son «atraídos» al surco gingival en respuesta a las señales quimiotácticas como la de la anafilatoxina C5a del complemento (Imagen tomada de: Biochem Pharmacol. 2010 Dec 15; 80(12):1992-2001.)
Asimismo se ha descrito que bacterias patogénicas orales tienen mecanismos para evasión de estas respuestas del SC principalmente mediante tres estrategias: (1) Mediante la inactivación proteolítica de los componentes; (2) por medio del reclutamiento de reguladores inhibidores del complemento y (3) secuestrando a los reguladores de los inhibidores del SC.
Referencias:
Peter Parham. Inmunología. 4a Edición. Ed. Manual Moderno. 2016. pp. 64-65
Damgaard C, et al. The complement system and its role in the pathogenesis of periodontitis: current concepts. J Periodont Res 2015.
Material adicional:
-En este link puedes encontrar una animación (en inglés) sobre el sistema del complemento.
– Artículo de revisión sobre la vía clásica y de la lectina del sistema de complemento.